Droghe da stupro: il GHB ed i suoi analoghi
Negli ultimi decenni si è assistito ad un notevole incremento di reati, e di alcuni in particolare, agevolati dall’utilizzo di sostanze psicoattive, tanto da denominare un genere criminoso specifico, i Drug-Facilitated Crimes, (DFCs; Shbair & Lhermitte, 2010; Shbair et al., 2010a e 2010b). I principali atti illeciti e criminali che vengono perpetrati con l’ausilio di sostanze farmacologicamente attive sono costituiti da furti, sequestri, aggressioni a scopo di violenza sessuale (Drug-Facilitated Sexual Assault; DFSA) sia di tipo occasionale che rituale (Ritual Abuse, RA; Marti, 2012; 2013), nonché raggiri, plagio e sottomissione della vittima alla volontà dell’abusante (Drug Submission) ed infine omicidi.
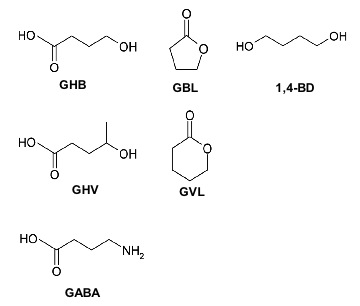
Nonostante gli intenti criminosi si siano preservati nei secoli, riproposti alla luce delle nuove tendenze culturali e sociali (Marti, 2012; 2013), la tipologia delle sostanze psicoattive impiegate ha subito un importante variazione ed incremento. Infatti, la ricerca farmacologica ha garantito un maggior numero di principi attivi disponibili, mentre la rete internet ha garantito la loro maggiore accessibilità e diffusione tra i potenziali consumatori (Relazione Annuale al Parlamento 2013). In questo articolo affrontiamo una categoria di sostanze divenute particolarmente famose nella cronaca giudiziaria per il loro impiego prevalente negli abusi di tipo sessuale. La molecola più conosciuta appartenente a questo gruppo è l’acido gamma-idrossibutirrico (GHB; fig 1) seguita dai suoi precursori metabolici quali il gamma-butirrolattone (GBL) ed il 1,4-butandiolo (1,4-BD). Inoltre, negli ultimi anni sono stati ritrovati anche altri composti con attività analoga al GHB ma senza esserne precursori, il gamma-idrossivalerato-metil-GHB (GHV) ed il gamma-valerolactone-4-pentanolide (GVL), precursore del GHV.
Impiego terapeutico del GHB
Il GHB sebbene sia considerato dai mass-media e dalla popolazione una “nuova” droga utilizzata prevalentemente a scopo ricreazionale (noto anche come “Liquid Ecstasy”, Liquid E”, Liquid X”, “Fantasy”, ecc.) e quindi relativamente poco conosciuta, in realtà è stata isolata e studiata dalla Laborit nel 1960 ed impiegata clinicamente come farmaco ipnotico per via endovenosa ed anestetico (Laborit et al., 1960, 1964), anche se successivamente è stato sostituito con altri farmaci più selettivi e con minori effetti collaterali. Attualmente è impiegato in clinica sotto forma di sale sodico per il trattamento della narcolessia (Boscolo-Berto et al., 2012), della dipendenza da alcol (Caputo et al., 2009) e recentemente è stato proposto per il trattamento sperimentale di pazienti affetti da Alzheimer (Mamelak, 2007).
In particolare, il sale sodico del GHB chiamato anche ossibato di sodio, è stato approvato dall’EMEA con il nome di Xyrem® (European Medicine Agency) per il trattamento di adulti affetti dalla narcolessia con cataplessia. Il farmaco ha concluso il suo iter registrativo anche in Italia nella riunione della Commissione Consuntiva Tecnico Scientifica (CTS) del 7-8 novembre 2006 ed è disponibile al commercio. In Italia il GHB viene commercializzato con il nome Alcover® ed è impiegato come coadiuvante nel controllo della sindrome di astinenza da alcol etilico, nella fase iniziale del trattamento multimodale della dipendenza alcolica e nel trattamento prolungato della dipendenza alcolica resistente ad altri presidi terapeutici, in coesistenza di altre patologie aggravate dall’assunzione di alcol etilico. (AIFA Agenzia Italiana del Farmaco, 2007). Lo Xyrem® (ossibato di sodio, 500 mg/ml) viene somministrato a dosi terapeutiche comprese tra 4,5 e 9 grammi al giorno in due dosi ugualmente suddivise, con dose massima giornaliera che non supera i 9 grammi. I pazienti dovrebbero generalmente iniziare il trattamento con dosi pari a 2,25 grammi al giorno con un aumento a scalare nell’arco di 1-2 settimane, a seconda della risposta individuale del paziente (Carter LP et al., 2009)
Perché il GHB e gli analoghi sono utilizzati come sostanze da stupro ?
L’impiego del GHB e dei suoi congeneri come sostanze utilizzate per compiere un atto di violenza sessuale (DFSA) è dovuto alle proprietà chimico-fisiche, organolettiche, farmacodinamiche e farmacocinetiche proprie dei composti. Infatti, questi principi attivi sono preparabili in forma liquida, sono ben miscibili con le bevande sia alcoliche che analcoliche (Elliott and Burgess, 2005) e sono tendenzialmente inodori ed incolori (Fig 2). Non presentano forti retrogusti (il GHB è leggermente salato nelle preparazioni non pure) che, tuttavia, possono essere ben mascherati nelle bevande edulcorate ed aromatizzate. Da un punto di vista farmacodinamico il GHB, il GBL ed il 1,4-BD si prestano bene ad essere utilizzate a scopo criminogeno in quanto possiedono un profilo d’azione caratterizzato da un iniziale stato euforico di disinibizione e rilassamento che mettono la vittima in una situazione di maggiore empatia e socializzazione con il soggetto abusante, consentendo a quest’ultima un migliore avvicinamento ed approccio. Successivamente allo stato euforico subentra uno stato di sedazione e stordimento che consente allo stupratore di prevaricare e vincere la reazione di resistenza della vittima. Infine, provocano uno stato di amnesia anterograda “chimica” che frammentando il ricordo degli avvenimenti durante l’effetto della sostanza, impedisce la ricostruzione della violenza subita. Inoltre, è stato ipotizzato che il GHB possa anche promuovere il desiderio sessuale (Nicholson and Balster 2001) anche se specifici studi riguardo a questo aspetto non sono stati ancora effettuati. Altresì, le caratteristiche farmacocinetiche ne favoriscono un buon assorbimento, una rapida metabolizzazione e successiva eliminazione dall’organismo, rendendone difficile la determinazione chimico-analitica nelle matrici biologiche (sangue, saliva ed urine) già dopo 24 ore. Pertanto, l’insieme di queste caratteristiche fisico-chimiche, organolettiche, farmacodinamiche e farmacocinetiche fanno si che il GHB ed i suoi congeneri siano pienamente adatti ad essere utilizzati per compiere reati di tipo sessuale, facendole rientrare a pieno titolo nelle così dette Drug-Facilitated Sexual Assault (DFSA).
Farmacologia e metabolismo del GHB e congeneri
Il GHB non è solamente uno xenobiotico di sintesi bensì una molecola endogena naturalmente presente nella maggior parte dei tessuti dei mammiferi, compreso il cervello (Maitre et al., 1997), dove viene sintetizzato nei neuroni GABAergici partendo dall’acido gamma-amminobutirrico (GABA; fig 1), un neurotrasmettitore endogeno primariamente di tipo inibitorio (per una review Nicholson and Balster, 2001). La funzione fisiologica del GHB è quella di neurotrasmettitore e/o neuromodulatore (Galloway et al., 1997; Maitre et al., 1997) coinvolto nel controllo del rilascio di differenti neurotrasmettitori quali dopamina, serotonina, acetilcolina, oppioidi endogeni e neurosteroidi (Drasbek et al., 2006). Da questa azione di neuromodulazione ne risulta che il GHB è coinvolto nei processi cerebrali che regolano i cicli di sonno-veglia, la regolazione della temperatura corporea, il metabolismo del glucosio e del flusso sanguigno cerebrale, la memoria ed il controllo delle emozioni. La sua azione farmacodinamica si esplica attraverso la stimolazione di due siti recettoriali uno specifico per il GHB (Benavides et al., 1982) e l’altro è ubicato nel recettore GABAB (Jensen and Mody, 2001; Carrai et al., 2008), conferendone ad alte dosi la tipica risposta di inibizione sulle funzioni centrali.
Dopo somministrazione orale il GHB viene rapidamente assorbito nell’intestino e distribuito in tutto il corpo, compreso il sistema nervoso centrale. È rapidamente metabolizzato e degradato ad anidride carbonica e acqua. L’emivita del GHB va da 20 a 60 minuti ed è completamente eliminato dal corpo entro 4-6 ore dopo l’ingestione, indipendentemente dalla dose assunta. Nel sangue si può rintracciare fino ad 8 ore dopo l’assunzione, mentre nell’urina fino a 12 ore. In media, meno del 5% di GHB si ritrova integro nelle urine umane entro 6-8 ore dall’assunzione. L’escrezione attraverso le feci è trascurabile (LeBeau and Mozayani 2001).
Proprio la presenza di GHB endogeno nell’organismo pone una problematica nella determinazione chimico-analitica di livelli di GHB nei reperti organici (fluidi biologici e matrici cheratiniche) derivanti dalla somministrazione volontaria o involontaria di GHB in caso di sospetta violenza. Infatti, il composto si degrada velocemente ed in tempi brevi (10-12 ore) e si raggiungono concentrazioni di GHB nei reperti biologici sovrapponibili a quelle di GHB endogeno normalmente presenti. Inoltre, in caso di reperti provenienti da cadavere bisogna considerare che i livelli di GHB aumentano significativamente. Infatti, in uno studio in 50 volontari sani le concentrazioni di GHB nel sangue oscillavano tra 0,11-1,56 mg/L, mentre nel sangue di 50 soggetti post-mortem le concentrazioni di GHB oscillavano tra 2.2-116 mg/L (Erdmann et al., 2006).
Pertanto, come spesso accade in caso di violenza sessuale, le vittime attendendo parecchie ore o giorni prima di denunciare la violenza, riducono la probabilità di poter determinare analiticamente concentrazioni di GHB ascrivibili ad una qualsiasi assunzione (LeBeau and Mozayani 2001). Nonostante la determinazione del GHB nei fluidi biologici sia difficile oltre le 24 ore dall’assunzione, l’esposizione al GHB in casi di violenza può essere documentata attraverso un’analisi del capello, anche dopo mesi di distanza dall’evento (Kintz et al., 2003) sia dopo singola (Scott-Ham and Burton, 2006) che ripetuta (Argo et al., 2012) assunzione. Nel caso di singola somministrazione la possibilità di detenzione nella matrice cheratinica è strettamente associata alla tipologia del capello, alla sua conservazione ed alla tecnica analitica.
Effetti ed interazioni del GHB
Il GHB è un potente sedativo ad azione rapida sul SNC. I suoi effetti psicoattivi appaiono entro 15-30 minuti dall’assunzione e durano circa 1-3 ore, mentre e gli effetti di hangover permangono 2-4 ore dopo l’ingestione. Dosi di GHB comprese tra gli 0,5-1,5 grammi/70Kg inducono uno stato di piacevole relax e tranquillità, placidità, sensualità, calore emotivo, disinibizione, euforia e piacevole sonnolenza. Dosi più elevate (≥2,5-3 grammi), possono indurre oltre alle precedenti manifestazioni cliniche potenzialmente piacevoli (potenziale d’abuso), degli effetti avversi caratterizzati da nausea, vomito, mioclono, bradicardia ed amnesia. Dosi superiori ai 3-5 grammi inducono confusione mentale, vertigini, ipotermia, abbassamento della pressione sanguigna, ipersalivazione, allucinazioni, amnesia a breve termine e sonnolenza fino agitazione o convulsioni, aggressività, bradicardia, depressione respiratoria, apnea e coma (morte). Da considerare con molta attenzione è il potenziamento degli effetti indotti dal GHB quando associato con altre sostanze psicoattive e deprimenti del SNC. In particolare un’associazione frequentemente impiegata in casi di violenza sessuale è con bevande alcoliche (McCabe et al., 1971). Infatti, l’impiego di etanolo consente di ridurre le dosi di GHB da somministrare e permette di veicolare il GHB con una bevanda facilmente proponibile alla vittima. Il suo effetto è potenziato oltre che dall’alcol, anche dalle benzodiazepine e da altri neurolettici. Le destro amfetamine, il naloxone, il trimetadone, e il valproato antagonizzano le variazioni encefalografiche prodotte dal GHB. Non sono comunque segnalati antagonisti del GHB utilizzabili a scopo antidotico in pratica clinica (Chin et al, 1992).
Analoghi del GHB
Altri due composti che vengono utilizzati a scopo ricreativo o criminogeno al posto del GHB sono il GBL ed il 1,4-BD. Il GBL, liquido o solido, è la forma lattonica del GHB (nomi da strada: “blue nitro”, “gamma g”, “midnight blue”, “renewtrient”) ed in forma liquida è incolore con un leggero odore residuo. E’ facilmente diluito in acqua e bevande alcoliche. Il 1,4-BD è un liquido igroscopico incolore ed praticamente inodore (nomi da strada: “somato-pro”, “serenity”, “enliven”). Dopo l’ingestione entrambi vengono convertiti in GHB nel corpo (Doherty et al., 1978; Lettieri and Fung, 1978). Il GBL viene metabolizzato in GBH da una sieronolattasi calcio-dipendente (Arena and Fung, 1980; Roth and Giarman, 1965) mentre il 1,4-BD è metabolizzato in GBH in due tappe ad opera dell’alcol deidrogenasi e dell’aldeide deidrogenasi. Il GBL è più potente del GHB pertanto, a parità di dose, gli effetti avversi causati dal GBL saranno più pronunciati ed il rischio di overdose maggiore (Carter et al., 2009). Entrambi sono utilizzati sia come sostanze d’abuso che in DFSA.
Abuso e Dipendenza
Il GHB è soggetto ad abuso da parte di due categorie. La prima include i body-builder che assumono il GHB come supplemento alimentare per aumentare i livelli dell’ormone della crescita (Takahara et al., 1977). La seconda include le persone che assumono il GHB per gli effetti euforici, disinibenti e sedativi (Maxwell and Spencer, 2005). Dopo un uso ripetuto di GHB si possono osservare sintomi tipici dell’astinenza, inclusi insonnia, ansia, tremori e sudorazione. Sindrome di astinenza grave sono stati riportati in soggetti a seguito di una overdose da GHB o analoghi, in modo particolare nel caso di assunzione contemporanea con altre sostanze psicoattive o con alcol. L’uso continuativo di GHB può indurre dipendenza (Le Beau and Mozayani, 2001).
Stato legale
In Italia, il GHB ed il suo precursore GBL sono sostanze incluse in Tabella I del D.P.R. 309/90 e quindi poste sotto controllo della vigente normativa in materia di stupefacenti. In Europa il GHB è una molecola posta sotto controllo secondo la UN Convention on Psychotropic Substances 1971, schedule IV. Inoltre, risulta posta sotto controllo nei seguenti Paesi: Austria, Belgio, Bulgaria, Danimarca, Estonia, Finlandia, Francia, Germania, Grecia, Ungheria, Irlanda, Lussemburgo, Malta, Olanda, Norvegia, Polonia, Portogallo, Romania, Slovacchia, Spagna, Svezia, Turchia, Regno Unito, USA, Nuova Zelanda.
Conclusioni
Nonostante la particolare attenzione dei media sull’impiego del GHB e dei suoi congeneri nei casi di DFSA, i casi di comprovato impiego di GHB in stupri e violenze sessuali rimangono bassi rispetto all’impiego di altre sostanze ipnotico-sedative. Infatti, in uno studio condotto in campioni di urina di vittime di violenza sessuale (ElSohly and Salamone SJ, 1999) il GHB è stato ritrovato solo nel 4% dei casi, rispetto alla presenza di benzodiazepine (8.2%), cocaina (8.2%) e mariujana (18.5%). Analogamente, un indagine francese condotta tra il 2003 e il 2006 dall’AFSSAPS (Agence Francaise de Securite Sanitaire des Produits de Sante) ha stimato che in solo in 7 casi su 242 accertati (2,89% del totale) era stato fatto uso di GHB a scopo di violenza sessuale (Shbair et al., 2010a).
Inoltre, in una valutazione retrospettiva che ha analizzato 11 studi, pubblicati tra il 1961 ed il 2009, il GHB è stato riscontrato nello 0,2-4,4% di tutte le aggressioni sessuali segnalate (Németh et al., 2010). Anche in Italia, negli ultimi 3 anni, il Sistema di Allerta Precoce del Dipartimento Politiche Antidroga (Presidenza del Consiglio dei Ministri) ha registrato solamente 15 casi documentati di intossicazione da GHB/GBL, anche se si ritiene che questi dati rappresentino solo una piccola parte dei casi reali e la situazione sia attualmente sottostimata (New Drugs. Update e Piano d’Azione Nazionale 2013).
Pertanto, sebbene il GHB ed i suoi analoghi rimangano per il loro profilo d’azione i composti ideali per commettere un’aggressione sessuale, al momento non risultano essere quelli maggiormente impiegati. Questo è probabilmente dovuto sia alla illegalità della detenzione del GHB e GBL ma anche alla difficoltà di raccogliere tempestivamente campioni biologici secondo le corrette procedure analitiche che in questo modo portano ad una sottostima del coinvolgimento di queste sostanze in casi di violenza sessuale (Karila et al., 2009).
Bibliografia
Arena C., Fung HL. (1980), Absorption of sodium gamma-hydroxybutyrate and its prodrug gamma-butyrolactone: relationship between in vitro transport and in vivo absorption. J Pharm Sci 69: 356-368.
Argo A., Vaiano F., Sortino C., Mari F and Bertol E. (2012), GHB: farmaco, sostanza d’abuso e droga da stupro: diverse tipologie d’uso, differenti problematiche analitico forensi. Italian Journal on Addiction 2: 28-33.
Benavides J., Rumigny JF., Bourguignon JJ., Cash C., Wermuth CG., Mandel P., Vincendon G., Maitre M. (1982), High affinity binding sites for gamma-hydroxybutyric acid in rat brain. Life Sci, 30: 953–961.
Boscolo-Berto R., Viel G., Montagnese S., Raduazzo DI., Ferrara SD., Dauvilliers Y. (2012), Narcolepsy and effectiveness of gamma-hydroxybutyrate (GHB): a systematic review and meta-analysis of randomized controlled trials. Sleep Med Rev, 16: 431–443.
Caputo F., Vignoli T., Maremmani I., Bernardi M., Zoli G. (2009), Gamma hydroxybutyric acid (GHB) for the treatment of alcohol dependence: a review. Int J Environ Res Public Health, 6: 1917–1929.
Carter LP., Pardi D., Gorsline J., Griffiths RR. (2009), Illicit gamma-hydroxybutyrate (GHB) and pharmaceutical sodium oxybate (Xyrem): differences in characteristics and misuse. Drug Alcohol Depend. 104: 1-10. doi: 10.1016/j.drugalcdep.2009.04.012.
Carai MA., Lobina C., Maccioni P., Cabras C., Colombo G., Gessa GL. (2008), Gamma-aminobutyric acid B (GABAB)-receptor mediation of different in vivo effects of gamma-butyrolactone. J Pharmacol Sci, 106: 199–207.
Chin MY., Kreutzer RA., Dyer JE. (1992), Acute poisoning from gamma-hydroxybutyrate in California. West J Med 156: 380-384.
Doherty JD., Roth RH. (1978), Metabolism of gamma-hydroxy-[1-14C] butyrate by rat brain: relationship to the Krebs cycle and metabolic compartmentation of amino acids. J Neurochem. 30: 1305-1309.
Drasbek KR., Christensen J., Jensen K., (2006), Gamma-hydroxybutyrate-a drug of abuse. Acta Neurol. Scand. 114: 145–156.
Elliott S. and Burgess V. (2005), The presence of gamma-hydroxybutyric acid (GHB) and gamrna-butyrolactone (GilL) in alcoholic and non-alcoholic beverages. Forensic Sci 151: 289-292.
ElSohly MA. and Salamone SJ. (1999), Prevalence of drug used in cases of alleged sexual assault. J. Anal. Toxicol. 23: 141-146.
Erdmann F., Zandt D., Auch J., Schütz H., Weiler G., Verhoff MA. (2006), Investigations concerning the threshold value between endogenous and exogenous GHB (liquid ecstasy). Arch Kriminol. 217: 129-136.
Galloway GP., Frederick SL., Staggers Jr. FE., Gonzales M., Stalcup SA., Smith DE. (1997), Gamma-hydroxybutyrate: an emerging drug of abuse that causes physical dependence. Addiction 92, 89–96.
Jensen K. and Mody I. (2001), GHB depresses fast excitatory and inhibitory synaptic transmission via GABA(B) receptors in mouse neocortical neurons. Cereb Cortex, 11: 424–429.
Karila L J., Novariiln J., Megarbane B., Cottencin O., Dally S., Lowenstein W., et al. (2009), Acide gamma-hydroxy-butyrique (GHB): plus qu’un agent de soumission chimique, une veritable source d’addiction. Press Med 38:1526-1538.
Kintz P., Cirimele V., Jamey C., Ludes B. (2003), Testing for GHB in hair by GC/MS/MS after a single exposure. Application to document sexual assault. J. Forensic Sci. 48: 195-200.
Laborit H. (1964), Sodium 4-hydroxybutirate. Int. J. Neuropharmacol 3: 433-452.
Laborit H., Jouany JM., Gerard J. and Fabiani F. (1960), Experimental studyand clinical application of sodium hydroxybutyrate. Rev. Agressol. 1, 397-406.
LeBeau MA. and Mozayani A. (2001), Drug-facilitated sexual assault. In: A Forensic Handbook. London: Academic Press.
Lettieri J., Fung HL. (1978), Improved pharmacological activity via pro-drug modification: comparative pharmacokinetics of sodium gamma-hydroxybutyrate and gamma-butyrolactone. Res Commun Chem Pathol Pharmacol. 22: 107-118.
Maitre M. (1997), The γ-hydroxybutirate signalling in brain: organization and functional implications. Prog. Neurobiol 51: 337-361.
Mamelak M. (2007), Alzheimer’ s disease, oxidative stress and gammahydroxybutyrate. Neurobiol Aging 28(9):1340-1360.
Maxwell JC., Spence RT. (2005), Profiles of club drug users in treatment. Subst Use Misuse 40:1409–1426.
McCabe ER., Layne EC., Sayler DF., Slusher N. and Bessman SP. (1971), Synergy of ethanol and a natural soporific-gamma hydroxybutirate. Science 171: 404-406.
Németh Z., Kun B., Demetrovics Z. (2010), The involvement of gamma-hydroxybutyrate in reported sexual assaults: a systematic review. J. Psychopharmacol. 24:1281-1287.
Nicholson KL and Balster RL (2001). GHB: a new and novel drug of abuse. Drug and Alcohol Dependence 63: 1-22.
Roth RH, Giarman NJ. (1965) Preliminary report on the metabolism of gamma-butyrolactone and gamma-hydroxybutyric acid. Biochem Pharmacol. 14:177-178.
Scott-Ham M and Burton F C (2006) A study of blood and urine alcohol concentrations in cases of alleged drug-facilitated sexual assault in the United Kingdom over a 3-year period. J. Clin. Forensic.Med 13: 107-111.
Shbair M.K.S., Lhermitte M. (2010) Drug-facilitated crimes: Definitions, prevalence, difficulties and recommendations. A review, Annales Pharmaceutiques Françaises, 68, 3: 136-147
Shbair M.K.S., S. Eljabour, Lhermitte M, (2010a) Drugs involved in drug-facilitated crimes: Part I: Alcohol, sedative-hypnotic drugs, gamma-hydroxybutyrate and ketamine. A review., Annales Pharmaceutiques Françaises, 68 (5): 275-285
Shbair M.K.S., Eljabour S, Bassyoni I, Lhermitte M, (2010b) Drugs involved in drug-facilitated crimes – part II: Drugs of abuse, prescription and over-the-counter medications. A review, Annales Pharmaceutiques Françaises, 68,(6): 319-331
Takahara J., Yunoki S., Yakushiji W., Yamauchi J., Yamane Y. (1977), Stimulatory effects of gamma-hydroxybutyric acid on growth hormone and prolactin release in humans. J. Clin Endocrinol Metab 44:1014-1017.
Sitografia
AIFA Agenzia Italiana del Farmaco, 2007: http://www.xyrem.com
European Medicine Agency. European Public Assessment Report (EPAR) summary for the public. Xyrem: http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Summary_for_the_public/human/000593/WC500057100.pdf
New Drugs. Update e Piano d’Azione Nazionale 2013 per la prevenzione e la diffusione delle nuove sostanze psicoattive (NSP) e dell’offerta in Internet, settembre 2013 http://www.politicheantidroga.it/media/605399/pan_nps_23_09_2013.pdf
Relazione Annuale al Parlamento 2013: http://www.politicheantidroga.it/progetti-e-ricerca/relazioni-al-parlamento/relazione-annuale-2013/presentazione.aspx